由于人们对于化学理论认识的不同,必然会产生对于化学反应机理认识的差别。例如在十九世纪六十年代出,当弗兰克兰的原子价学说初步建立时,化学家们就认识到氮的原子价是3或5;而现代人们则以未配对电子的数目为原子价数,通常认为氮的原子价为3,而氧化数则可以是5。在铵盐中,若以共价键看待,原子价为5;若以离子键(NH4+X-)看待,氮的原子价则是3,那么,如何有4个相同的N-H键而不称为4价呢?由此可以看出现代化学的理论概念还是有很多难以解决的问题存在。
看下面截图:
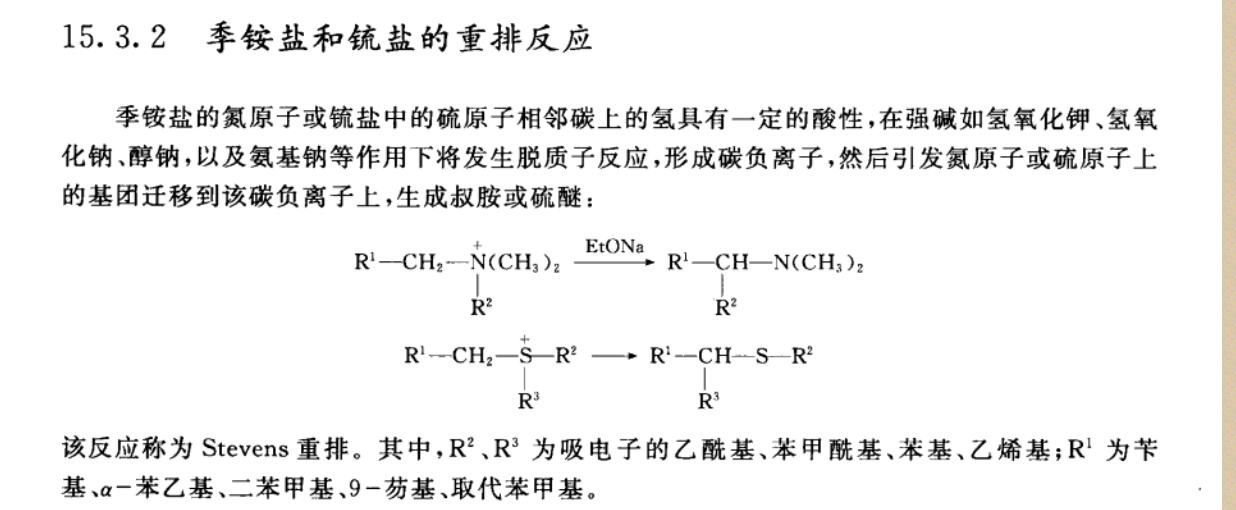
(此图截自有机化学,古练权等编著)
该反应机理是以季铵盐、锍盐为离子化合物,具有一定酸性的氢原子可以给出质子的理论观点为出发点来阐明的。
然而,铵盐等易分解,没有比较高的熔点、沸点,没有离子化合物所应有的基本属性,仅仅因为其溶液可以导电等性质就认为是离子化合物,证据明显不足,而作者则认为它是五价氮的分子型化合物。因此对上面的反应机理有不同的观点。
季铵盐本身就具有一定酸性,可以和强碱反应产生季铵碱;那么,认为碳原子上面的酸性氢原子与强碱发生脱质子的反应就证据不足,因为其酸性极弱。同时,季铵碱还有一种特殊的反应——霍夫曼消除反应。该反应消去的是β位氢原子,产生烯烃和胺。
而Stevens重排,消去的则是α位的氢原子,这说明不同位置的氢原子其活性受到其它相关基团的影响,因此可以看到图中的R2、R3的吸电子基团就是α位的氢原子活化的原因。
季铵盐与强碱反应,因为五价氮上面的吸电子原子或者基团最为活泼,从碱夺取电子,产生有极强夺取氢原子能力的羟基等基团,在温和条件下面与氮原子结合即为季铵碱,在不够温和的条件下面,有继续发生反应的倾向;羟基如果夺取了β位氢原子,那么它就会发生霍夫曼消除反应;而如果羟基夺取了α位的氢原子,那么就产生了两个相邻的不稳定原子,且碳原子上面少一个原子为3价,氮原子有4个原子键合,不是最稳定的3价,也不是比较稳定的5价,这多一、少一且相邻,因此就很容易发生基团的转移反应,这就是重排反应发生的原因所在。
作者提出共价化合物在溶液中的电导,不是因为电离的原因,而是因为和溶剂作用产生了复合化合物,它可以从阴极向阳极运送电子而使得溶液产生导电现象。因此,不能认为溶液存在电导性就认为发生了电离作用,酸溶液中其实不存在水合氢离子,晶体的X射线衍射看到的是带电子的氢原子而非质子。这应该引起我们深切的思考。