世界卫生组织(WHO)提出的“关切的变异株”有 5 个,分别为阿尔法(Alpha)、贝塔(Beta)、伽玛(Gamma)、德尔塔(Delta) 和奥密克戎(Omicron),目前 Omicron 株感染病例已取代 Delta 株成为主要流行株,奥密克戎还在继续变异,出现了BA1,BA2,BA3,BQ1 ,XBB等等亚变异株。现有证据显示 Omicron 株传播力 强于 Delta 株,但致病力有所减弱。人群感染后或接种新冠病毒疫苗后可获得一定的免疫力,随着时间的推移,体内的抗体又会逐渐下降。预防新冠病毒的疫苗虽已上市,但因病毒的频繁变异,影响了疫苗的使用,甚至于失效。有必要研究新冠病毒的变异规律,开发新型的疫苗。
从新冠疫情一开始我国就在开展新冠疫苗的研制,现在已获批并且开展免疫接种的疫苗至少包括:5种灭活疫苗、2种病毒载体疫苗、5种基因工程重组蛋白疫苗。
灭活疫苗,是指新冠病毒在体外培养的vero细胞中增殖之后,通过β-丙内酯、福尔马林、加热和化学方法等手段对病毒进行灭活处理,但保持免疫原性的死病原体制备而成的疫苗。灭活疫苗可由整个死病毒组成,也可由其裂解片段组成。灭活疫苗具有相对稳定、安全,制作简单等优点。但也存在接种剂量大、免疫期短、免疫途径单一等缺点。灭活疫苗已有5家公司获批生产,在疫情初期得到广泛的应用。随着疫情的缓解,需要接种疫苗的人数锐减。灭活新冠病毒疫苗也逐渐退出,大多数厂家已经停止生产。
病毒载体疫苗是以腺病毒或流感病毒作为载体,用基因工程技术获得含保护性抗原基因的重组病毒。可诱导产生相应抗体,从而达到免疫接种的目的。现有两家公司的病毒载体疫苗被批准上市,一家是使用5型腺病毒载体的吸入型重组新冠病毒疫苗,还有一家是鼻喷型流感病毒载体新冠病毒疫苗。
重组蛋白疫苗是通过基因工程方法,在工程细胞内表达纯化病原体的抗原蛋白。然后制备成疫苗,其产能高、成本低,具有较强的可及性。目前获批使用的重组蛋白疫苗有,有四家是使用哺乳动物CHO细胞生产的重组新冠病毒蛋白疫苗,其中北京神州细胞公司生产的是重组新冠病毒4价S三聚体蛋白疫苗。还有一家是用昆虫sf9细胞生产的重组新冠病毒疫苗。
mRNA通过“翻译”指导蛋白质的生产。以mRNA疫苗为例,其原理就是将编码抗原的mRNA通过不同的递送方式递送到人体细胞内,在细胞内翻译后产生相应的抗原蛋白,从而有效激起细胞免疫和体液免疫。mRNA疫苗在生产过程中没有保护剂,不添加抗生素,也不需要佐剂,自带免疫原性,没有动物源性,安全性突出。此外,mRNA疫苗研发的制备生产周期非常短,它是一种平台技术,易于放大,因此适用于应急性的疫苗。欧美等国家主要使用的是mRNA疫苗和腺病毒载体疫苗,我国也有石药集团公司获批mRNA疫苗生产销售。
除了肌肉注射的疫苗外,还研发了两款新的剂型。一种是鼻喷的新冠疫苗,这是以减毒的流感病毒载体开发的新冠疫苗。鼻喷新冠疫苗使用时直接喷入鼻腔内,简化了给药过程。它能在人上呼吸道中产生抗体,建立免疫屏障。我们知道新冠病毒是通过上呼吸道的ACE2受体结合进入细胞实现感染的,鼻喷新冠疫苗能快速激活呼吸道固有免疫应答,而在上呼吸道建立免疫保护,阻挡病毒进入肺部。
还有一种是吸入式新冠疫苗。以5型腺病毒为载体,利用对人体无害的腺病毒携带新冠病毒的S蛋白基因而开发的新冠疫苗。疫苗经雾化形成小颗粒,可吸入到人体肺细胞中。产生的S蛋白质能形成免疫反应,刺激人体生成抗体。它除了有传统的体液免疫和细胞免疫外,还有黏膜免疫,而肌肉注射的疫苗是不能产生黏膜免疫的。吸入式疫苗和注射式疫苗两者的结合使用,给身体提供了全面的免疫保护。
在接种疫苗之后,随着时间推移,抗体的滴度会逐渐下降,而外界的病毒也在不断的变异。会观察到疫苗“失效”,再次感染。有研究表明,65岁以上老年人在接种两剂新冠灭活疫苗后,新冠重症保护效率达到58.9%。再次接种灭活疫苗或mRNA疫苗加强针,重症保护效率分别提高到88%和95.2%。所以接种疫苗的主要目的不仅仅防感染而且能防重症。其原因是因为接种疫苗后体内会产生大量有效抗体的记忆B细胞,在病毒侵入后,这些记忆B细胞很快会被激活,在3-7天内产生新的抗体。从而可以减少重症和死亡风险,减少住院病人,保护了医疗系统,使之不至于被大量病人的涌入而崩溃。
以往我们研发的疫苗,是根据现有流行毒株所制造的,它只能够防御当时流行的毒株。一旦出现全新的毒株,基本上就没什么作用了。面对新冠极具变异性和逃逸性的特征,人们有了研发能应对新的变异株或者亚株的想法。而不仅仅是被动的追随变异,不停的开发适应新变异株的新疫苗。为了能获得一种能够覆盖绝大多数变异株的广谱免疫原,我国科学家在分析NCBI数据库中的2675条新冠病毒S蛋白序列后。通过进化聚类,计算所有突变位点的发生频率,设计了一种覆盖共性突变的拟合新抗原(Span)。最终获得了一种覆盖共性突变的拟合新抗原 Span ,由此而开发出“广谱疫苗”。
研究表明Span序列位于S蛋白系统发育树的中心位置。通过进化计算得到的共性突变,反应了S蛋白突变的趋同规律,说明它具有覆盖未来变异株的潜力。进一步的研究得到的6个共性突变位点在以后爆发的Omicron亚系毒株中均有保留,显示出很强的共性规律和预见性(如图所示)。
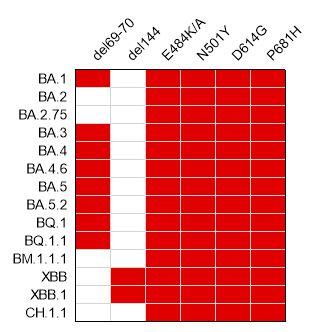
图示:研究中发现6个共性突变位点(横向标记),在后来爆发的Omicron流行株中有很大程度的保留(红色表示位点保留)。
基于病毒的进化共识序列,优化设计疫苗免疫原的广谱疫苗设计的新策略,研发出了一种覆盖“共性突变”的广谱疫苗免疫原,它可诱导产生针对Alpha、Beta、Gamma、Eta、Kappa、Delta、Lambda 和 Omicron 变异株及其亚株系在内的广谱中和抗体。
动物实验结果与设计预期相符,在动物免疫2针原型株S蛋白再加强免疫1针Span蛋白后。与免疫3针原型株S蛋白相比,Span能诱导出针对WT、Beta、Delta、Omicron毒株及其亚毒株广泛的中和抗体,能100%保护小鼠免受Omicron毒株的致死性攻击。与对照组比较,原型株免疫原(wt)无法提供跨奥密克戎毒株的有效交叉保护。
需要特别指出的是,Span是在Delta出现之前就完成设计的,却能高效诱导针对Delta和Omicron及其变异株的广谱中和抗体,表明免疫原设计策略具有前瞻性。因此,基于新冠的共性进化突变设计的泛新冠病毒S蛋白免疫原(Span),有望成为预防新冠病毒现有以及未来潜在变异流行株的广谱多价疫苗。
基于这种变异规律的研究,有两家公司研发了多价的广谱新冠病毒 疫苗,并且已经获得批准上市销售。先是北京神州细胞生物技术公司研发了新冠重组蛋白四价疫苗 ,该疫苗能够针对Beta变异株,和Omicron中的(BA.1/BQ.1.1/XBB.1三种亚株)变异株,一共4种变异株。通过工程细胞培养获得结构高度一致的三聚体抗原蛋白,添加比传统铝佐剂更能显著增强Th1细胞免疫的水包油乳液佐剂制备而成,是全球首个获批上市的包含四个新冠病毒变异株的广谱四价新冠疫苗。
后来又有成都威斯克生物医药公司,研发出重组三价新冠病毒(含有XBB+BA.5+Delta变异株)三聚体蛋白疫苗。它利用昆虫杆状病毒载体大,具有容纳多个基因的特点。把设计的多价抗原基因插入整合到载体中,构建后的表达载体在昆虫sf9细胞中生产新冠病毒疫苗,成为抗三种变异株的疫苗。以上两家公司的疫苗都通过了国家相关部门批准,纳入市场紧急使用。