一、概述
基因工程制药是利用现代生物技术手段,通过改造生物体的遗传物质来生产药用蛋白或多肽的一类制药技术。
基因工程药物就是先确定对某种疾病有预防和治疗作用的蛋白质,然后将控制该蛋白质合成过程的基因取出来,经过一系列基因操作,最后将该基因放入可以大量生产的受体细胞中去(包括细菌、酵母菌、动物或动物细胞、植物或植物细胞),在受体细胞不断繁殖,大规模产具有预防和治疗这些疾病的蛋白质。
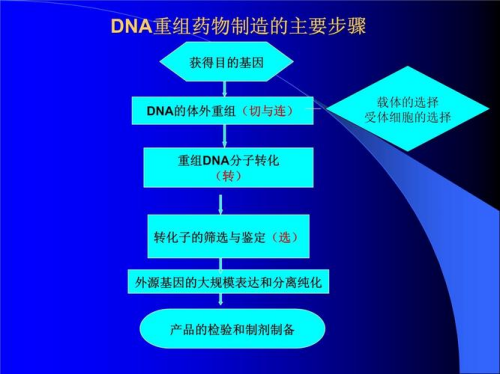
图表1:基因工程制药主要步骤
二、基本原理
1.中心法则应用
(1)遗传信息传递机制解析基于DNA→RNA→蛋白质的遗传信息流动原理,通过外源基因的表达来生产目标蛋白药物。
(2)疾病研究与治疗
① 病毒学研究:RNA病毒(如HIV)通过逆转录酶将RNA逆转录为DNA,整合到宿主基因组中,这一过程是抗逆转录病毒药物的靶点。
② 基因疗法:通过载体将正常基因导入患者细胞,利用中心法则的转录翻译机制补偿缺陷基因功能
(3)生物技术应用
① 基因工程:通过体外重组DNA技术,将外源基因导入宿主细胞,利用宿主细胞的转录翻译系统生产目标蛋白(如胰岛素)。
② RNA干扰技术:利用小RNA分子特异性降解目标mRNA,阻断基因表达,用于功能基因组学研究及疾病治疗。
(4)进化与物种多样性研究
2.分子克隆技术 :分子克隆技术是分子生物学中的核心技术之一,其核心原理是通过体外重组将目标基因与载体结合,经宿主细胞扩增后实现特定DNA序列的大规模复制。
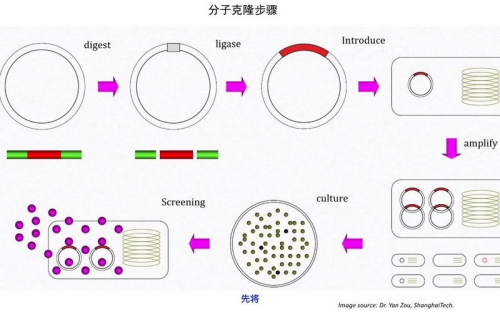
图表2:分子克隆主要步骤
3.蛋白质合成机制 :利用宿主细胞的转录翻译系统合成外源蛋白。
(1)转录阶段
① DNA模板解旋:RNA聚合酶结合启动子区域,解开DNA双链,以其中一条链为模板合成mRNA前体。
② mRNA加工:前体需剪接去除内含子,并在5'端添加帽子结构、3'端添加多聚腺苷酸尾,形成成熟mRNA。
(2)翻译阶段
① 起始阶段
核糖体小亚基识别mRNA的5'端帽子结构和起始密码子AUG,携带甲硫氨酸的起始tRNA与之结合,随后大亚基组装形成翻译起始复合物。
② 延长阶段
氨酰tRNA依次进入核糖体A位,肽酰转移酶催化肽键形成,核糖体沿mRNA从5'→3'方向移动,每延伸一个氨基酸消耗4个高能磷酸键。
③ 终止阶段
遇到终止密码子(UAA/UAG/UGA)时,释放因子促使新生肽链释放,核糖体解离。
(3)翻译后修饰
新生肽链需经折叠、二硫键形成、糖基化等修饰,原核生物在细胞质完成,真核生物则依赖内质网和高尔基体协作加工。
(4)调控机制
① 转录调控:通过转录因子和DNA甲基化等表观遗传修饰实现。
② 翻译调控:miRNA可抑制mRNA稳定性或翻译效率,泛素蛋白酶体系统降解错误折叠蛋白。
该过程通过遗传密码的方向性、连续性及简并性特性,确保翻译的高效性与准确性。
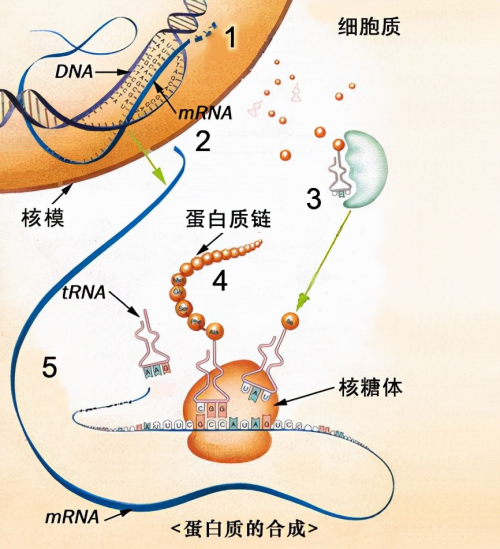
图片3:蛋白质合成
三、关键技术
1. 目的基因获取
(1)化学合成法
基因制药中的化学合成法是一种广泛应用于短链DNA合成的技术,其核心原理是通过固相亚磷酰胺法逐步构建核苷酸链。
① 基础原理
第一、固相合成:将首个核苷酸的3'-OH端通过烷基臂固定在固相载体(如硅胶珠)上,5'-OH端用二甲氧基三苯甲基(DMT)保护。
第二、循环反应:每个合成循环包含四个步骤。
a.去保护:用酸性溶液去除DMT基团,暴露5'-OH以便后续反应。
B.偶联:加入经四唑激活的核苷酸单体,与5'-OH形成磷酸二酯键。
C.加帽:乙酰化未反应的5'-OH,防止错误延伸。
D.氧化:将亚磷酸三酯氧化为稳定的磷酸三酯结构。
② 技术特点
第一、长度限制:通常适用于200bp以下的寡核苷酸合成,超过此长度需依赖酶促法或其他组装技术。
第二、自动化程度高:支持高通量合成,但复杂结构(如双价siRNA)可能面临纯度低、产率低等问题。
第三、化学修饰兼容性:可引入硫代磷酸酯(PS)等修饰,但exNA等特殊修饰会增加合成难度。
(2)cDNA文库筛选 :
cDNA文库筛选是基因制药中的关键技术,其原理涉及从特定细胞中提取mRNA并构建代表该细胞转录组的cDNA克隆库。
① 文库构建基础
第一、mRNA来源:从目标组织或细胞中提取总RNA,通过oligo(dT)磁珠富集poly(A)+ mRNA。
第二、反转录过程:使用逆转录酶将mRNA转化为单链cDNA,再通过DNA聚合酶合成双链cDNA。
第三、载体连接:双链cDNA与质粒/噬菌体载体连接,形成重组DNA分子并导入宿主菌群。
② 文库质量关键指标
第一、代表性:文库需覆盖细胞中全部表达的mRNA种类,人类细胞文库通常需≥106克隆(99%概率包含所有转录本)。
第二、完整性:包含5'非编码区、编码区和3'非翻译区,确保基因功能研究需求。
第三、载体选择:噬菌体载体适合全长cDNA克隆(装载容量大),质粒载体则便于高通量筛选。
③ 筛选技术原理
第一、杂交法:使用放射性或荧光标记的探针(如cDNA探针)与文库克隆杂交,特异性结合目标基因。
第二、PCR扩增:针对已知序列设计引物,通过PCR从文库中扩增目标基因。
第三、表达筛选:若目标产物为蛋白质,可通过抗体检测表达产物(如ELISA)筛选阳性克隆。
(3)PCR扩增 :
PCR扩增是基因制药中用于特异性扩增DNA片段的核心技术,其原理基于DNA半保留复制特性,通过循环变性、退火和延伸三步反应实现目标基因的指数级扩增。
① 扩增循环原理
第一、变性(94-98℃):高温使双链DNA解旋为单链模板。
第二、退火(50-65℃):引物与单链DNA特异性结合,退火温度需低于引物熔解温度(Tm值)3-5℃。
第三、延伸(72℃):Taq DNA聚合酶以dNTPs为原料,沿5'→3'方向合成新链。
② 关键组分
第一、Taq酶:耐高温DNA聚合酶,避免每轮循环重新添加。
第二、特异性引物:20-30碱基的寡核苷酸片段,决定扩增目标区域。
第三、dNTPs与缓冲液:提供合成原料并维持反应环境(如Mg²⁺)。
(4)基因编辑技术 :
基因编辑技术在基因制药中的应用基于对DNA序列的精确修改,目前最成熟的技术是CRISPR-Cas9系统。
CRISPR-Cas9技术原理
RNA引导切割:通过设计的单导向RNA(sgRNA)识别目标DNA序列,并将Cas9酶引导至特定位置。
第一、DNA双链断裂:Cas9酶像分子剪刀一样切割目标DNA,产生双链断裂(DSB)。
第二、细胞修复机制:
A.易错修复(NHEJ):导致随机插入或缺失,使基因功能失活。
B.精准修复(HDR):需提供模板DNA,实现特定序列的插入或替换。

图片4:目的基因的获得方法
2. 表达载体构建
(1)常用载体:
基因制药中常用的载体主要包括质粒、噬菌体和病毒载体。
①质粒载体
第一、结构特性:小型环状DNA分子,独立于宿主染色体,含复制原点(Ori)、多克隆位点(MCS)和标记基因(如抗生素抗性基因)。
第二、工作原理:通过限制性内切酶切割质粒DNA,插入目的基因后导入宿主细胞,利用复制原点实现自我复制。
② 病毒载体
第一、常见类型:腺病毒、慢病毒、逆转录病毒等,通过感染机制将外源基因整合至宿主基因组。
第二、设计关键:去除病毒致病基因,保留感染和整合功能,携带治疗性基因序列。
③ 噬菌体载体
第一、特性:以λ噬菌体为代表,可包装长片段DNA(~50kb),通过感染细菌实现基因扩增。
第二、操作要点:需构建噬菌体基因组与目的基因的重组体,利用噬菌体包装蛋白体外组装感染颗粒。
(2)必需元件
基因制药中的必需元件主要包括载体系统、调控元件及宿主细胞表达系统。
① 载体系统
第一、质粒载体:含复制原点(Ori)、多克隆位点(MCS)和标记基因(如抗生素抗性基因),通过限制性内切酶切割和连接酶重组,实现外源基因的克隆与扩增。
第二、病毒载体:如腺病毒或慢病毒,通过改造去除致病基因并携带治疗性基因,利用天然感染机制实现高效转导。
第三、噬菌体载体:适合大片段DNA(如λ噬菌体,~50kb),通过体外包装感染宿主细胞。
② 调控元件
第一、启动子:位于基因上游,招募RNA聚合酶启动转录,其序列决定表达强度和特异性。
第二、终止子:标记转录终点,确保RNA分子完整性。
第三、增强子/沉默子:远距离调控基因表达,通过DNA环化与启动子相互作用。
③ 宿主细胞表达系统
第一、原核系统(如大肠杆菌):成本低、生长快,但缺乏真核修饰功能。
第二、真核系统(如CHO细胞):可进行糖基化等修饰,适合复杂蛋白药物。
第三、工程菌优化:通过控制碳源、补料速率等减少代谢副产物(如乙酸)对表达的抑制。
(3)启动子
① CMV
CMV启动子源自人巨细胞病毒基因组,具有强效转录活性,可显著提升外源基因在哺乳动物细胞中的表达效率。其增强子区域含多个转录因子结合位点,通过激活宿主细胞转录机制实现高效基因表达。
② lac
基因制药中Lac(乳糖操纵子)的应用主要基于其作为原核生物基因表达调控的经典模型。Lac操纵子的结构组成。
A.结构基因群
第一、lacZ:编码β-半乳糖苷酶,催化乳糖分解为葡萄糖和半乳糖。
第二、lacY:编码乳糖通透酶,促进乳糖跨膜运输。
第三、lacA:编码转乙酰基酶,参与乳糖代谢副反应。
B.调控元件
第一、启动子(P):RNA聚合酶结合位点。
第二、操纵基因(O):阻遏蛋白结合位点。
第三、调节基因(I):编码阻遏蛋白,通过负调控抑制转录。
③ T7
第一、T7 RNA聚合酶
具有高度启动子特异性,仅识别T7启动子序列。转录效率是大肠杆菌RNA聚合酶的5倍,可实现超高表达。
第二、T7启动子
序列为TAATACGACTCACTATAGGG,为强启动子与T7 RNA聚合酶形成专一性转录复合物。
(4)筛选标记(抗生素抗性基因)通过载体携带的抗生素抗性基因(如氨苄青霉素抗性基因ampr)使成功转化的细胞在含抗生素培养基中存活,未转化细胞被淘汰。
(5)复制起点
复制起点是DNA分子上启动复制的特定序列,包含识别和结合复制蛋白的保守区域,确保载体在宿主细胞内的稳定扩增。
(6)克隆位点
克隆位点是载体DNA上专为外源基因插入设计的特定序列区域,通常包含多个限制性内切酶识别位点,构成多克隆位点(MCS)12。其核心作用是为目的基因提供定向插入的接口。
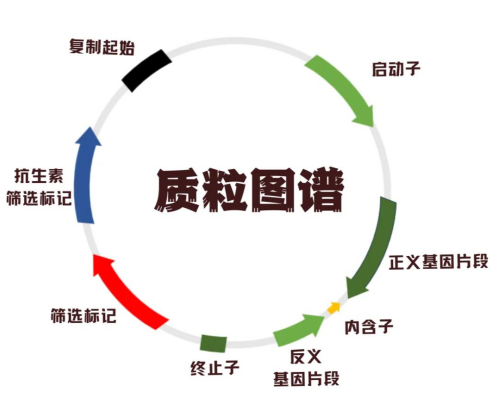
图片5:基因表达载体构建
3.宿主系统选择
需根据目标蛋白特性(如翻译后修饰需求、分子量、溶解性)选择宿主系统,例如:需糖基化修饰的蛋白应选用哺乳动物细胞(如CHO细胞)原核蛋白表达首选大肠杆菌系统。
(1)原核表达系统 (大肠杆菌):
通过质粒将外源基因(如胰岛素基因)导入大肠杆菌,利用其高效表达系统进行蛋白合成。质粒作为运载体,可在宿主细胞内自我复制并携带目标基因。典型载体包含复制起点(ori)、多克隆位点(MCS)及筛选标记。
第一、优点:成本低、周期短、产量高。
第二、缺点:缺乏翻译后修饰。
第三、代表产品:
a.胰岛素
胰岛素是由胰脏内的胰岛β细胞分泌的一种蛋白质激素,是机体内唯一具有降血糖功能的激素,同时参与调节糖原、脂肪和蛋白质的合成代谢12。其核心作用机制是通过与细胞表面受体结合,促进葡萄糖摄取利用,抑制肝糖原分解及糖异生,从而维持血糖平衡。
b人生长激素
(2)真核表达系统 :
外源基因通过载体导入真核细胞(如CHO细胞、HEK293细胞)后,在宿主细胞的核糖体上完成翻译过程,生成具有天然构象的蛋白质。
① 酵母系统:有基础糖基化,如毕赤酵母。
② 昆虫细胞:杆状病毒表达系统。
③ 哺乳动物细胞(CHO、HEK293)。
代表产品:单克隆抗体、EPO。
图片6: 基因制药宿主系统选择
4. 转染与筛选
通过物理/化学方法将外源DNA/RNA导入宿主细胞质,依赖电荷相互作用形成复合物穿过细胞膜。真核细胞需通过有丝分裂期核膜融合实现基因入核。
(1)转染方法:
① 电穿孔
通过瞬时高压电脉冲(通常200-1000V/cm)使细胞膜磷脂双分子层发生重排,形成瞬时亲水性微孔(直径约1-2nm),外源DNA/RNA通过电泳作用进入细胞内部。
② 脂质体
由磷脂两性分子(亲水头部+疏水尾部)自发组装形成中空囊泡结构,内层疏水区可包载脂溶性药物,亲水内核容纳水溶性活性成分。通过添加胆固醇(增强稳定性)、可电离脂质(如DLin-MC3-DMA)或靶向配体(如抗体片段)实现性能优化。
③ 病毒转导
(2)稳定转染细胞株筛选:
抗生素加压筛选:载体携带的抗生素抗性基因(如氨苄青霉素抗性基因Ampᵣ)编码特定酶,可分解对应抗生素或修饰其作用靶点,使成功转化的细胞在含药培养基中存活。
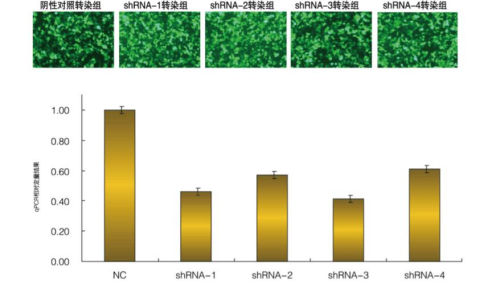
图表7:基因制药-转染与筛选
5. 蛋白纯化技术
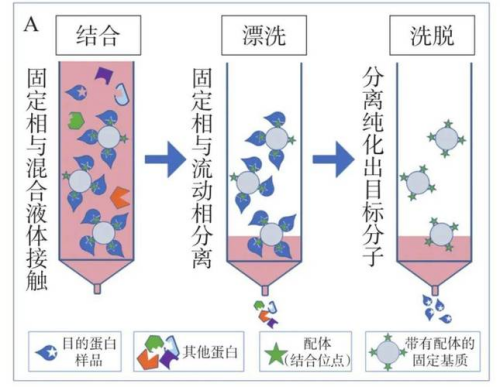
(1)亲和层析(镍柱、Protein A/G等)
亲和层析(Affinity Chromatography)是一种基于生物分子间特异性相互作用的层析技术,通过固定化配体选择性捕获目标分子实现高效分离纯化。
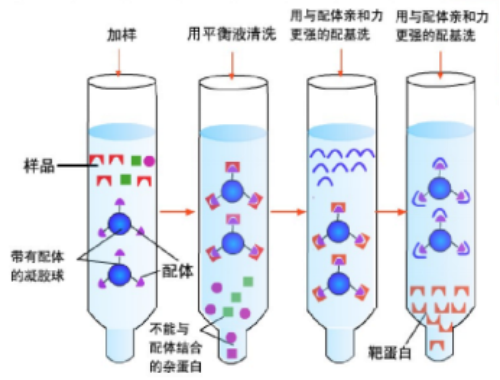
图表8:亲和层析
(2)离子交换层析
离子交换层析(Ion Exchange Chromatography, IEC)是一种基于物质表面电荷差异进行分离的色谱技术,广泛应用于生物大分子(如蛋白质、核酸)的纯化。
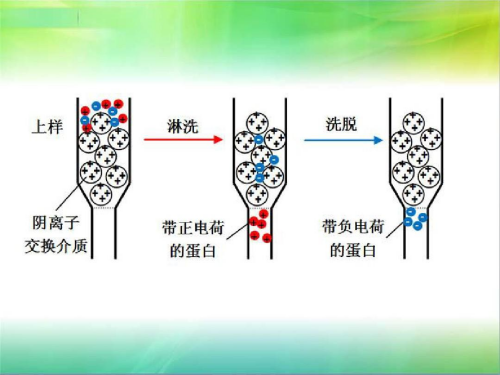
图表9:离子交换层析
(3)分子筛层析
分子筛层析(Molecular Sieve Chromatography)是一种基于分子尺寸差异进行分离的层析技术,其核心原理是利用多孔凝胶填料的筛分效应实现物质分离。
图片10:分子筛层析
(4)疏水相互作用层析
疏水相互作用层析(Hydrophobic Interaction Chromatography, HIC)是一种基于生物大分子表面疏水性差异进行分离的层析技术,广泛应用于蛋白质、多肽等生物大分子的纯化。
图片11:疏水相互作用层析
基因工程制药技术现已发展成为生物医药产业的核心支柱,随着合成生物学、人工智能等技术的融合,其应用范围和效率将持续扩展提升。
参考文献
1.中国政府官网
2.中国科技部官网
3.国家自然科学基金委官网
4.中国科学院科研进展官网
5.中国卫健委官网
6.中国医科院官网
7.中国医科院医药生物研究所官网
8. 中国医药生物技术协会官网
9.中国生物工程学会官网
10.中国工业信息化产业部官网
11.中国科学院微生物研究所官网
12.中国轻工业联合会官网
13.中国生物发酵产业协会官网
14.中国生物发酵工程协会官网
15.中国生物技术信息官网
16.中国生物技术发展中心
17.中国数子科技馆官网
18.中国遗传学会官网
19.中国生物医学工程学会官网
20.史海龙 浅析我国基因制药发展的现状 中国卫生产业 . 2011 ,8 (28)
21.李哲 转基因技术在我国生物制药领域的应用与发展 中国医药技术经济与管理 . 2008 (06)
22.重组人胸腺素Tα1产业化开发 长春市科技信息研究所 2008-01-15
23.吕渭川贺秉坤 我国基因制药产业:路途艰辛前景诱人 中国国际高技术成果交易会生命科学与生物技术产业论坛论文集 2006
24. 丁锡申 基因制药产业化发展概况 生物工程进展 . 2001 (05)
25.基因制药产业化规模居国内领先 张兆军 朱新庆 王要武
26.陈云弟 转基因制药 科学 . 2000 ,52 (04)
27.新兴的基因制药产业 今山 科学之友 . 1998 (05)