一、概述
微生物酶是指由微生物活细胞产生的蛋白质,这些蛋白质在生物体系中起着催化生物体系中特定反应的、由微生物活细胞产生的蛋白质。作为催化剂的微生物酶,它可以加速三种反应:水解反应、氧化反应和合成反应。
微生物酶是促进生物化学反应的高效物质。酶参与机体的各种生化反应,没有酶就没有生命。酶广泛存在于所有生物体内,细菌、真菌等微生物是各种酶制剂的主要来源。
细菌产生的酶大部分在细胞内,称为胞内酶,如氧化还原酶;有些酶则被分泌到细胞外,称为胞外酶,如一些水解酶。微生物酶不仅在细胞内催化各种生化反应,还在细胞外参与物质代谢和能量转换等重要生命活动。
微生物酶的研究和应用在生物技术和医学领域具有重要意义。通过对微生物酶的研究和利用,可以改善人类的生活,推动生命科学的发展。例如,基因编辑、干细胞技术和靶向药物等关键技术的实现都离不开酶的作用。此外,微生物酶的活性可以通过化学修饰或非共价结合配体进行调节,这种调节可以在数秒至数分钟内完成,具有高效和精确的特点。
图片1:微生物酶概念
二、分类
1.氧化还原酶类(Oxidoreductase)促进底物进行氧化还原反应的酶类,是一类催化氧化还原反应的酶,可分为氧化酶和还原酶两类。
(1)氧化酶
氧化酶能够催化底物分子中的双键或其它官能团发生氧化反应,促进电子传递链中的质子泵激活,从而加速氢离子的跨膜运动,提高细胞内ATP合成速率。这个过程不仅加速了细胞呼吸,提供了更多的能量支持细胞活动,还参与了脂肪分解、能量代谢、抗氧化防御和红细胞寿命延长等生理过程。
(2)还原酶
还原酶的技术作用机理主要包括催化电子传递过程,将电子从氧化态物质转移到还原态物质,从而调控细胞内的氧化还原状态,影响细胞内某些分子的活性和功能。
2.转移酶类(Transferases)
(1)作用场所:转移酶主要位于核糖体大亚基,特别是在50S/60S亚基中。
(2)催化步骤:
第一、识别结合:转移酶首先识别并结合在核糖体P位点的肽酰-tRNA1。
第二、切断肽键:转移酶切断肽酰-tRNA与tRNA之间的酯键,使游离的肽酰基释放出来。
第三、转移肽酰基:然后将游离的肽酰基转移到A位点氨基酰-tRNA的α-氨基上,催化形成新的肽键(-CO-NH-)。
3.水解酶类(Hydrolases )
水解酶是一种生物酶,主要通过分解大分子有机物质为小分子化合物,从而促进营养成分的释放。其基本工作原理是通过裂解大分子化合物的化学键,使其变成小分子化合物,从而促进营养成分的释放。水解酶对分子间的化学键具有高效和专一性,对具有不同特性的化学键具有不同的作用方式。
4.裂合酶类(Lyases)
催化从底物(非水解)移去一个基团并留下双键的反应或其逆反应的酶类,许多裂合酶催化逆反应,使两底物间形成新化学键并消除一个底物的双键,合酶便属于此类。
5.异构酶类(Isomerases)
催化各种同分异构体、几何异构体或光学异构体之间相互转化的酶类,例如异构酶、表构酶、消旋酶等。
6.合成酶类(ligase)
通过模拟酶的活性中心和催化机制,利用化学合成法制备高效、高选择性的新型催化剂。酶通过其特定的构象与氨基酸侧链基因相连,形成具有高选择性和催化特性的活性结构,表现出高效、专一的催化特性。催化两分子底物合成为一分子化合物,同时偶联有ATP的磷酸键断裂释能的酶类。
图片2:微生物酶多种形式
三、理化性质
酶作为蛋白质类生物催化剂,其理化性质主要包括高效催化性、高度专一性、蛋白质结构特征(如两性解离与等电点)以及对环境条件的敏感性。具体表现为:催化效率比一般化学催化剂高10^7-10^13倍;对底物具有绝对/相对/立体异构专一性;可溶于水但易受温度、pH等因素影响而发生变性或活性改变。酶作为蛋白质类生物催化剂,其理化性质主要包括高效催化性、高度专一性、蛋白质结构特征(如两性解离与等电点)以及对环境条件的敏感性。具体表现为:催化效率比一般化学催化剂高10^7-10^13倍;对底物具有绝对/相对/立体异构专一性;可溶于水但易受温度、pH等因素影响而发生变性或活性改变。
四、技术原理
(一)功能作用
酶的功能作用广泛且多样,是生命活动的核心驱动力。作为生物催化剂,酶通过降低反应活化能显著提高化学反应的速率,其作用贯穿于生物体的各类生理过程。
1.酶在信号转导和细胞活动调控中发挥关键作用,例如激酶和磷酸酶通过催化蛋白质的磷酸化与去磷酸化,调控细胞周期、分化和凋亡。
2.酶直接参与运动功能的实现,如肌肉收缩依赖ATP水解酶催化三磷酸腺苷(ATP)分解,释放能量驱动肌纤维滑动。在主动运输中,细胞膜上的ATP酶(如钠钾泵)通过水解ATP提供能量,逆浓度梯度转运离子,维持细胞内外离子平衡。
图片3:酶工作机理
(二)酶在消化系统中起着决定的作用
1.蛋白酶将蛋白质分解为氨基酸
蛋白酶是一类能够催化蛋白质水解的酶。它们通过特定的机制识别并断裂蛋白质中的肽键,从而将蛋白质分解成较小的片段即,即由多个氨基酸通过肽键连接而成的短链。蛋白酶水解蛋白虽然主要产物是多肽,但在水解过程中,也有可能生成少量的游离氨基酸,这是因为不同的蛋白酶所催化的肽键不同,某些蛋白酶可能正好在蛋白质的特定位置断裂肽键,从而释放出单个的氨基酸。
图片4:蛋白酶催化转化氨基酸
2.淀粉酶催化淀粉水解为葡萄糖
在生物体内,淀粉的分解反应是在酶的催化下进行的。主要有两种酶参与这个过程:α-淀粉酶和β-淀粉酶。它们能够特异性地识别并切割淀粉分子中的糖苷键,从而将淀粉水解成较小的糖分子。这些较小的糖分子进一步被其他酶水解,最终生成葡萄糖。
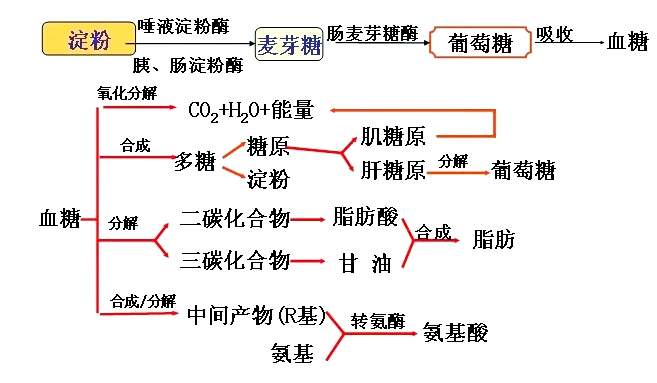
图片5:淀粉酶催化淀粉水解为葡萄糖
3. 纤维素酶催化转化葡萄糖
纤维素酶催化转化葡萄糖纤维素酶是一种生物催化剂,它能够将纤维素分解成可被其他生物利用的葡萄糖。纤维素是植物细胞壁的主要成分,由许多葡萄糖分子组成。在纤维素酶的作用下,这些葡萄糖分子被分解成更小的片段,最终被转化成葡萄糖。
在动物的消化系统中,纤维素酶能够将植物细胞壁中的纤维素分解成可被吸收和利用的营养物质。其次,纤维素酶在生物能源领域也有着广泛的应用。通过利用纤维素酶将植物纤维转化成乙醇等生物燃料,可以减少对化石燃料的依赖。
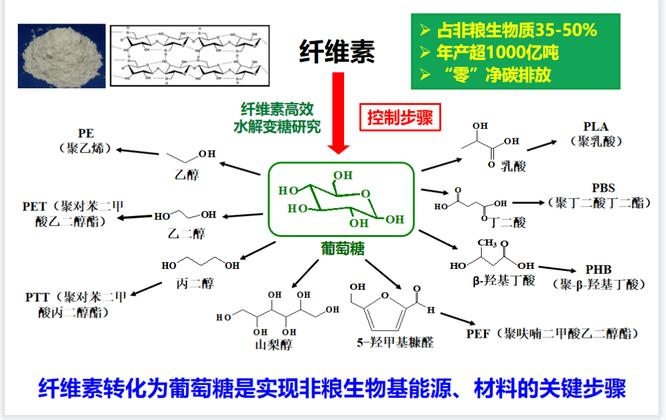
图片6:纤维素酶催化转化葡萄糖
(二)作用特点
1.高效性
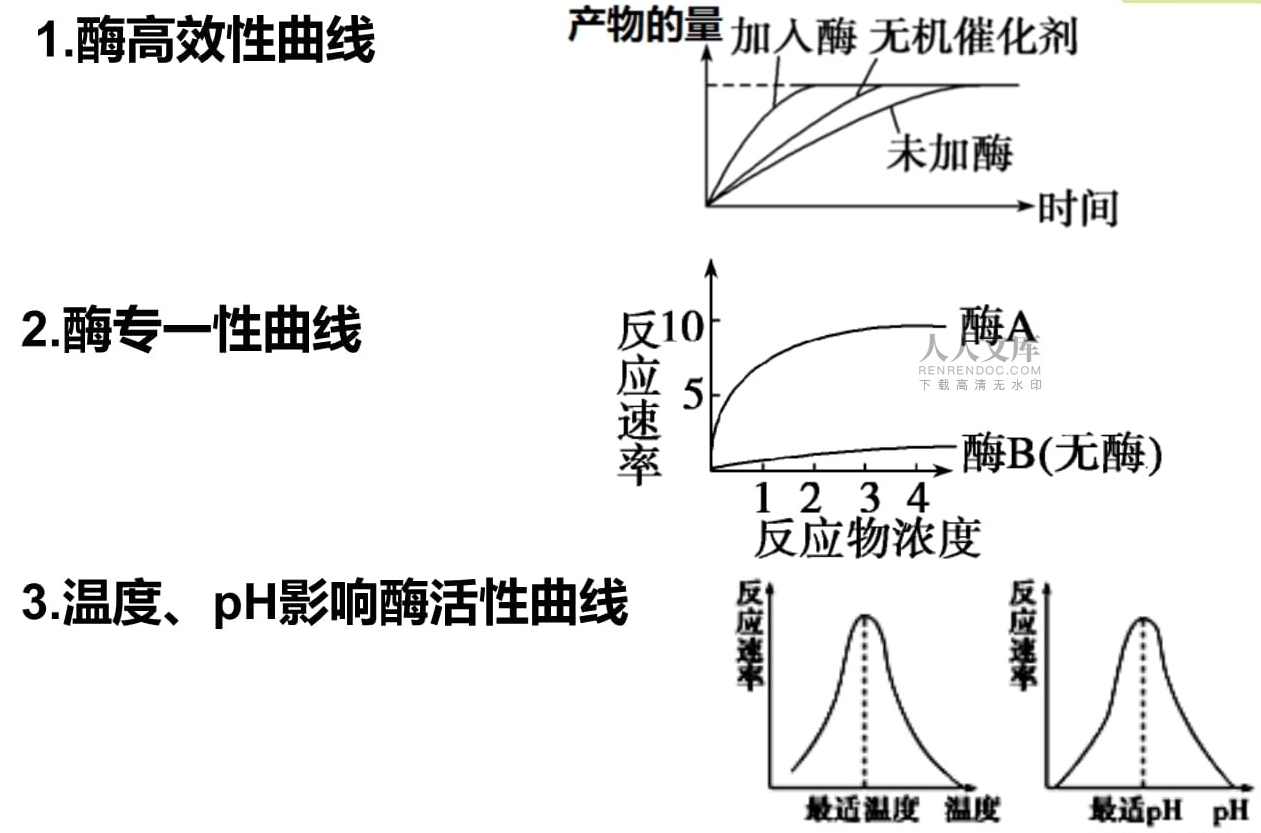
(1)微生物酶具有极高的催化效率,能够大幅加速化学反应速率。同时,酶对底物具有高度的选择性,即催化专一性,只能催化特定的化学反应。
(2)酶高效性源于其特殊的络合物结构排列和降低反应活化能的能力
第一、酶具有特定反应的适宜部位,这些部位能够与反应物精确结合,形成中间络合物。
第二、这种特殊的结构排列使得酶能够高效地催化特定反应,而不与其他非相关分子发生作用。
第三、酶通过中间络合物的形成,降低了化学反应所需的活化能。
第四、活化能是化学反应发生的能量门槛,降低活化能意味着反应更容易进行,从而提高了反应速率。
第五、酶的高效性得益于其特殊的结构排列和降低反应活化能的能力,这使得酶能够在生物体内高效、专一地催化各种生化反应。
第六、酶的催化效率远超一般催化剂。与非酶促反应相比,酶促反应速率可提高 108∼1020倍;相较于其他催化剂(如金属离子),其催化效率也高出 107∼1013倍。
2.专一性
酶对底物的选择具有严格的特异性,一种酶只能催化一类物质的化学反应,即酶是仅能促进特定化合物、特定化学键、特定化学变化的催化剂。酶的专一性不仅体现在对底物的选择上,还现
在对反应条件的要求上。例如,一种酶可能只在特定的pH值或温度下才能发挥其催化作用。
3.反应条件温和
绝大多数酶为蛋白质,其催化作用需在常温、常压及近中性pH条件下进行。高温、强酸、强碱、重金属等易破坏酶蛋白的构象,导致变性失活。
4.不稳定性
酶的催化活性依赖于特定空间构象,外界环境变化(如温度波动、pH偏离最适范围、有机溶剂或紫外线照射)可迅速引起酶变性,丧失催化功能。
5.可调控性
酶的催化活性在细胞内受到严格的调节控制,其调控方式很多,如结构调节、抑制剂调节、激活剂调节、共价修饰调节、反馈调节、激素调节等,使酶催化反应在细胞内能有条不紊地进行。
图片7:酶高效催化反应
(三)技术原理
酶的技术原理涉及多种学说和试验证据,具体可归纳为以下核心理论:
1.中间产物学说
该学说认为,酶催化反应时首先与底物(S)结合形成酶-底物复合物(ES),随后复合物分解为产物(P)并释放酶(E),反应式为:
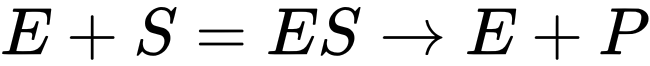
酶通过形成中间复合物显著降低反应活化能。中间产物学说解释了酶如何通过与底物结合形成酶-底物复合物,并促进反应的进行。中间产物学说的机制是,酶与底物结合后,通过改变底物的化学结构,将底物转化为中间产物。这个中间产物可能是不稳定或高能态的,因此很容易进一步反应形成产物。这样,酶通过将底物转化为中间产物,降低了反应的活化能,从而加速了反应的速率。
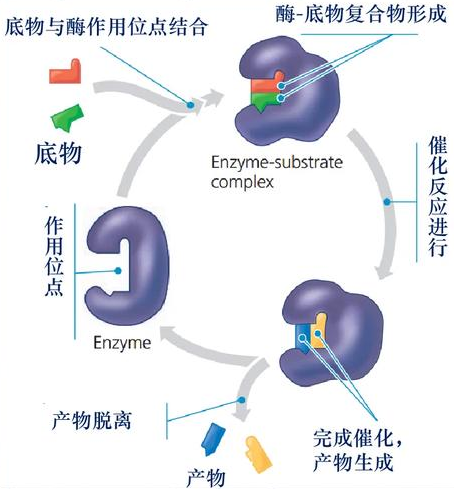
图片8:酶中间产物学说
2.锁钥学说
关于酶作用专一性的关键理论,1890年由Fischer提出,认为酶与底物的结合类似“钥匙与锁”的互补关系,酶活性中心的刚性结构与底物分子严格匹配,通过物理作用使底物敏感键扭曲,促使其进入过渡态。该理论以锁钥与门孔的比喻来解释酶与底物的结合过程。根据这一假说,酶与底物之间的结合就像一把钥匙需要精准地插入锁孔,底物至少需要与酶的三个功能团进行精确匹配,每个功能团都有特定的空间结构。这种结合的专一性确保了酶只对特定底物起作用,同时也解释了酶变性后失去催化活性的现象。
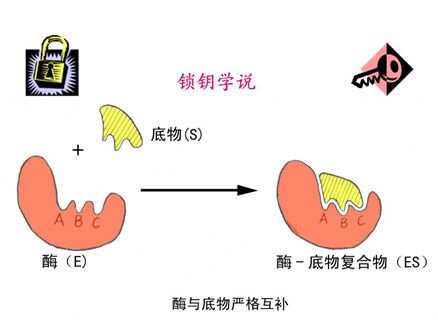
图片9:酶锁钥学说
3.多位点亲和理论
1948年Ogston研究柠檬酸转化时发现,酶的活性中心需至少三个结合位点以固定底物的特定基团,从而保证反应的立体特异性。这一理论补充了锁钥学说,解释了酶对立体异构体的选择性催化。
4.诱导契合学说
酶的诱导契合学说是1958年由美国科学家Koshland提出的经典酶作用理论,该理论革新了此前 “锁与钥匙学说” 中酶与底物为刚性结合的认知。当底物与酶接近时,能诱导酶的构象发生有利于底物与之结合的变化,使酶与底物特异结合,催化反应的进行。若将酶的活性中心比作一只柔软的手套,底物则如同形状独特的手,在两者接触前,手套(酶活性中心)的形态与手(底物)并非完全契合;当手(底物)伸入手套(酶活性中心)时,手套(酶)会根据手的形状进行自适应调整,贴合手的轮廓,形成紧密包裹的状态。这一过程如同酶与底物结合时,底物会诱导酶的结构产生构象变化,使酶的活化部位与底物形成互补关系,进而形成稳定的酶 - 底物复合物,推动反应向过渡态转化,显著提升酶催化反应的速率。
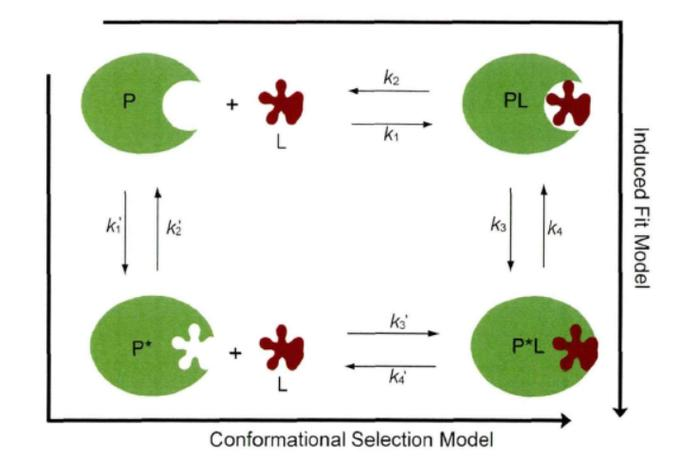
图片10:诱导契合学说
(四)调节机制
酶的调节机制通过控制酶活性或数量确保生物体内代谢活动的平衡与效率,主要分为以下两类:
(1)酶活性的调节
第一、别构调节
别构酶具有别构效应,即,从而改变酶的活性。别构酶通过一些小分子化合物与酶蛋白分子活性中心以外的部位(别构部位)结合,这种结合不改变酶与底物的共价结构,而是通过改变酶分子的空间构象来影响其催化活性。引起酶蛋白分子构象变化,从而激活或抑制催化活性。
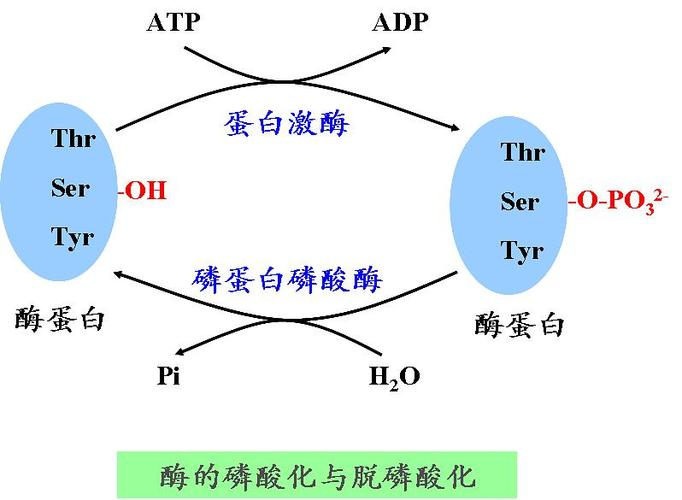
第二、可逆共价修饰
酶蛋白肽链上的一些基团可在其他酶的催化下,与某些化学基团共价结合,或者又在另一种酶的催化下,去掉已经结合的化学基团,从而影响酶的活性。这种修饰方式允许生物系统在特定的时间和空间内灵活地调节其分子的活性状态,从而实现对细胞功能和代谢途径的精细控制。
第三、酶原激活
酶在合成或初分泌时无活性,这类酶的前身称为酶原。酶原在特定条件下,经过切断特异肽键或去除部分肽段,改变酶的构象,形成具有活性的三维结构,从而转变为有活性的酶。此过程是不可逆的,意味着酶由无活性状态转变为活性状态。酶原在一定条件下,被水解掉一个或几个特定的肽段,转变为有活性的酶的过程称为酶原激活。
图片12:酶原激活调节
(2)酶含量的调节
第一、合成调控
诱导酶:在微生物细胞中,受特定诱导物刺激后基因表达上调而合成的酶。当某种底物或代谢产物浓度升高时,它们可作为诱导剂与特定的受体蛋白结合,进而激活基因转录因子(如RNA聚合酶),促进相关酶基因的转录和翻译, 增加酶的含量。特定底物(如乳糖)诱导合成(如大肠杆菌半乳糖苷酶)。
第二、降解调控
酶分子稳定性受生理状态影响。当产物或某些中间代谢产物积累到一定浓度时,它们可能作为阻遏物与受体蛋白结合,抑制基因转录因子的活性,从而减少相关酶基因的转录和翻译,降低酶的含量。
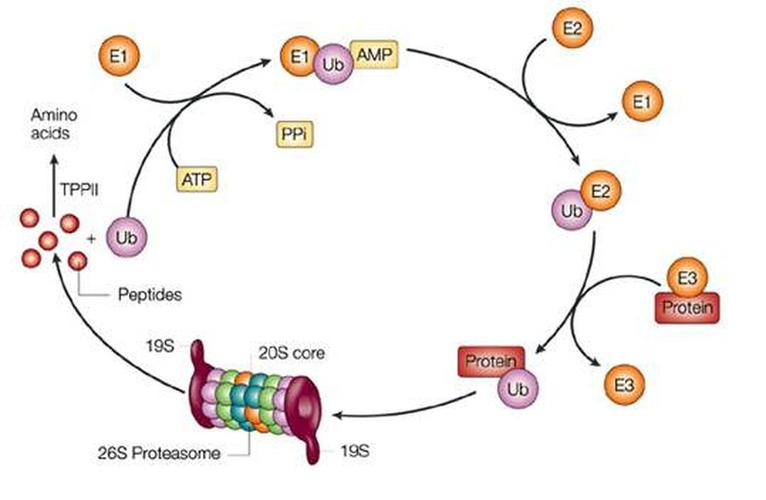
图片13:酶含量调节
(五)酶活性影响因素
酶的活性受多种因素影响,主要包括底物浓度、酶浓度、温度、pH值、抑制剂及激活剂等。
1.底物浓度
底物浓度是影响酶活性的重要因素。在底物浓度很低时,反应速度随底物浓度的增加而急骤加快,两者呈正比关系,表现为一级反应。随着底物浓度的升高,反应速度不再呈正比例加快,反应速度增加的幅度不断下降。如果继续加大底物浓度,反应速度不再增加,表现为0级反应。
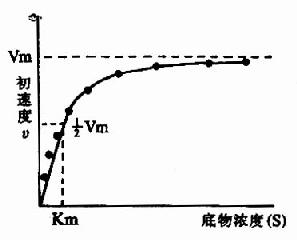
图片14:底物浓度
2.酶浓度
在其它条件一定的情况下,当底物浓度足以使酶饱和的情况下,酶的浓度与酶促反应速度成正比关系。
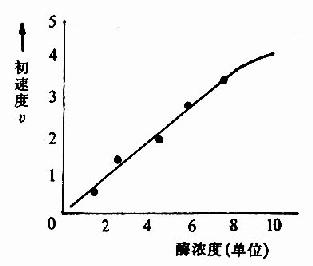
图片15:酶浓度
3.温度
温度对酶活性的影响表现为双重效应:一方面是正向效应:温度升高加速分子运动,提高酶与底物的碰撞概率,从而加快反应速率。另一方面是负向效应:高温破坏酶蛋白的氢键和疏水作用,导致其三维结构变性失活。
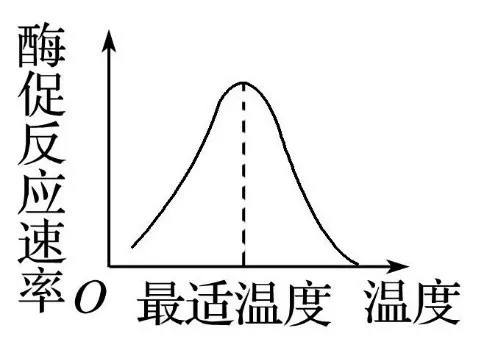
图片16:酶促最适温度
4.pH值
每种酶仅在特定pH范围内具有活性,最适pH时活性最高。偏离最适pH会导致酶构象改变或底物解离状态异常,从而抑制活性。
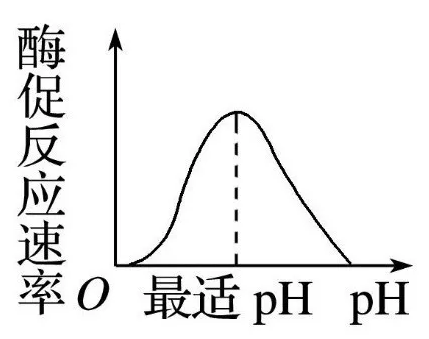
图片17:酶促最适PH值
五、技术展望
微生物酶催化技术,利用酶或微生物细胞、动植物细胞作为生物催化剂进行催化反应的技术,在多个领域展现出显著优势。酶作为生物催化剂,相较于化学催化剂,在常温、常压和近中性条件下即可进行高效催化反应,不仅投资少、能耗低,而且操作安全。其催化效率和反应速度极高,可达化学催化反应的107~1013倍。生物催化技术及其核心成分——酶,在多个领域展现出广阔的应用前景和显著的优越性。随着科学技术的不断发展,生物催化技术将在未来发挥更加重要的作用。
参考文献
1.中国政府官网
2.中国科技部官网
3.国家自然科学基金委官网
4.中国科学院科研进展官网
5.中国工业信息化产业部官网
6.中国科学院微生物研究所官网
7.中国生物工程学会官网
8.中国轻工业联合会官网
9.中国生物发酵产业协会官网
10.中国生物发酵工程协会官网
11.中国生物技术信息官网
12.中国农业科学院微生物研究所官网
13.中国数子科技馆官网
14.李伟 刘博 许文静 微生物在生物基催化剂制备中的应用 工业微生物 . 2024 ,54 (02)
15.韩佳旭 王莉 新型固定化酶技术的研究进展 江西化工. 2024 ,40 (02)
16.沈方园 葛萧 张晓宇 张郁勃 周慧姿 李恒 重组酶聚合酶扩增技术的研究进展 微生物学通报 . 2024 ,51 (05)
17.陈兴浩 李鑫 沈海潇 张校培 重组酶扩增技术概述及应用研究进展 中国动物检疫. 2023 ,40 (11)
18.阮圣慧 姜彩霞 刘晓兰 郑喜群 酶法制备低聚异麦芽糖的研究现状 食品工业科技. 2023 ,44 (17)
19.杨琴 龚来觐 李鹤酶 技术在食品加工与检测中的应用 中国食品工业. 2022 (23)
20.廖川 韦贵将 重组酶聚合酶扩增技术的研究进展与应用 检验医学与临床. 2022 ,19 (22)
21.王艳菊 现代酶工程技术的应用及发展 生物化工. 2022 ,8 (04)
22.汪寄宇 食品酶工程关键技术及其安全性评价 生物化工. 2022 ,8 (03)
23.施宁雪 靳晶豪 陈孝仁 重组酶聚合酶扩增技术及其在生命科学领域的应用 江西农业学报. 2021 ,33 (10)
24.王亚楠 陈昌国 重组酶聚合酶扩增技术研究进展 解放军医学杂志. 2021 ,46 (05)