前言
近年来,随着肿瘤免疫学研究的不断深入,极大地改变了癌症进展的概念,逐步发现,癌症进展不仅取决于癌细胞本身,还在很大程度的取决于宿主体内的免疫系统,及正在发展的肿瘤之间的相互作用。癌症免疫学是一个不断发展的领域,研究免疫细胞和癌细胞之间的复杂机制和相互作用,旨在识别基于免疫疗法的治疗靶点。调动免疫系统杀灭肿瘤细胞,已成为临床肿瘤治疗策略应用研究关注的焦点。
在一些临床的病例中,许多病例预后效果显示,在免疫药物研发方面,均取得了前所未有的进展。有部分取得了FDA的认证,有临床治疗效果显著的病例,出现预后痊愈的可喜结果。新获批的免疫疗法包括,调控免疫系统重要因子药物、基因编辑患者自身的T淋巴细胞,以及用以识别和攻击患者肿瘤细胞的治疗方法。
近期,虽然肿瘤免疫疗法在临床研究应用中,显示出令人鼓舞的效果,正在逐步扩大临床应用范围观察。然而,存在的一些亟待解决的问题,如为何免疫疗法只针对某些患者起效?起效的患者如何获得持久的缓解效应?临床肿瘤的多元素联合疗法能否改善患者对免疫疗法的响应程度?仍需要深入研究揭示耐药细胞的分子基础与作用机制。利用基因组测试,找出有潜力的生物分子标枳物,以辅助设计出靶向患者特异性肿瘤新型抗原的个性化疫苗。
随着对肿瘤发病、癌变和癌细胞转移扩散的分子基础的逐步深入研究,针对不同类型的实体瘤和血液肿瘤,尤其是针对那些具有较强扩散力的肿瘤,有效的治疗途径和方法正在研发。同时,通过识别癌症进展过程或根除的多种途径,日益认识到了免疫反应在癌症治疗方面的关键潜力。
目前,正在采用的免疫治疗方法,癌细胞和免疫系统基因的分析方法,尤其是RNA微阵列分析和单细胞RNA测序的出现,赋予了肿瘤免疫学家和生物信息学家海量收集数据的能力。依据这些数据,临床医生们几乎能为所有类型的癌患重症选择更优化的放化疗或免疫治疗策略。这些策略包括:(1)免疫检查点的肿瘤强效杀伤效应;(2)个性化癌症突变定制疫苗;(3)嵌合抗原受体疗法(Chimeric antigen receptor therapy,CAR); (4) 肿瘤干细胞新药研发。
本文重点讨论免疫检查点的阻滞抑制剂的临床研究进展与应用前景。
1.免疫检查点的阻滞
1.1免疫检查点抑制剂
免疫检查点抑制剂(Immune checkpoint inhibitors,ICI)可以抑制因为免疫系统的“刹车”,而导致的耐药性,而广泛用于临床治疗。免疫检查点在多种肿瘤中具有较强的杀伤效应。
通常免疫检查点通过单用或联用抗体阻断细胞毒性淋巴细胞相关蛋白4(cytotoxic T lymphocyte associated protein 4,CTLA-4)或程序性死亡因子(programmed cell 1,PD-1)来实现。诱导免疫应答的主要前提是预先存在受特异性免疫检查点抑制的抗肿瘤T细胞。迄今,临床上癌症免疫治疗采用的都是免疫检查点的阻断,大部分对免疫检查点抑制剂有响应的患者,肿瘤可以长期受控。有部分患者仍然会复发。目前对获得性耐药机制研究不是很多,但有实验结果表明,耐药性可能与抗原和干扰素信号传递途径的改变相关。新一代疗法的组合有望解决免疫检查点治疗的抗性问题。
1.2程序性死亡因子-PD-1与配体-PD-L1
程序性细胞死亡因子(prograammed cell death,PD-1)通过与其在肿瘤内细胞表面上表达的配体,程序性细胞死亡配体1,(prograammed cell death ligand 1,PD-L1相结合,产生负向调节抗肿瘤T细胞的效应功能。PD-1发挥抑制功能是由酪氨酸磷酸酶SHP-2去磷酸化T细胞受体(TCR)下游的信号分子介导。PD-1具有两个配体,PD-L1和PD-L2,PD-L1广泛表达于暴露在促炎细胞因子环境中的细胞表面,PD-L2则限制性表达于抗原呈递细胞中。肿瘤微环境中由炎症诱导的PD-L1表达导致PD-1介导的T细胞耗竭,从而抑制肿瘤细胞毒性T细胞应答。
随着癌症从原发点转移,抗肿瘤体细胞反复识别同源肿瘤抗原。TCR被触发后导致促炎细胞因子的合成,其中包括IFN-ƴ。IFN-ƴ 是反应性PD-L1表达的最强刺激物。T细胞被长期暴露与同源抗体,从而导致靶细胞的反应性PD-L1表达,而持续性PD-1信号则会诱导T细胞耗竭的表观遗传程序激活。目前PD-1途径中仍存在一些尚未知的相互作用的功能和意义。有证据显示,PD-L1可与T细胞上表达的共刺激分子CD80(B71)相结合,产生抑制信号。排斥性指导分子b(Repulsive guidance molecule b, RGMb)
与PD-L2结合,但不与PD-L1结合,似乎与肺耐受相关。
PD-1是免疫应答的负调节因子,在癌患发生发展中起重要作用。阻断它,便优先刺激抗肿瘤T细胞。与CTLA-4缺陷型小鼠相比,PD-1缺陷型小鼠表型更为健康,原因是除了利用其他方式诱导外,这类小鼠绝大部分不会发生自身免疫性疾病。因此,阻断PD-1能够特异性的激活抗肿瘤T细胞,较阻断CTLA-4而言,抑癌效果更显著,毒性更小。
2. PD-1和PD-L1阻滞疗法的临床效果
目前,依据潜在的生物学和多种类型的癌症患者的持久性临床试验反应率,确证了利用PD-1通路的阻断性治疗的疗效。针对11种癌症适应症患者,FDA批准了5种PD-1或抗PD-L1抗体应用于临床,这是癌症史上令人鼓舞的最重要的进步之一!
PD-1能阻断抗肿瘤活性的首个证据来自采用完全人单克隆抗体nivoLumab(MDX-1106 / BMS936558)。 2006年10月,nivoLumab首次在1期单次输注剂量递增实验中进行人体试验,这是首例人类PD-1阻断试验。在每2周接受一次nivoLumab注射的16名初期患者中,6名(37.5%)患者有客观肿瘤反应,其中患者黑色素瘤、肾细胞癌等患者。在I期实验中,抗肿瘤活性的早期证据伴随着小量毒性,偶见肺炎发生。而nivoLumab的I期实验,数据非常漂亮,大大加速了该抗体和其他抗PD-1/PD-L抗体的临床试验进展。抗PD-1抗体pembrolizumab于2011年4月进入临床实验。基于nivoLumab的临床数据,pembrolizumab的临床实验专注于转移性黑色素瘤和NSCLC患者,并进行了肿瘤学史上最大的I期实验,实验中招募了1235名患者。
首先获得FDA批准的PD-1阻断抗体疗法,是pembrolizumab和nivoLumab,2014年被批准用于难以根治的黑色素瘤患者,2015年被批准用于NSCLC。申请是经由快速审批通道。首个获批的是抗PD-L1抗体,2016年被批准用于治疗尿路上皮癌的是atezolizumab ,2017年被批准用于治疗Merkel细胞癌的是avelumab。 这类药物是首次依据其遗传特征而获得FDA批准临床试验的。其中,2017年还批准了pembrolizumab和nivoLumab用于治疗任何器官的具有微卫星不稳定性肿瘤。这种快速药物研发和快速的适应症规模性临床试验,得益于PD-1阻断抗体的临床活性的一系列特征。一旦产生了客观的肿瘤反应,通常,其抗肿瘤效果都能持续很长一段时间。
目前,靶向致癌基因疗法中,大多数抗肿瘤反应只能持续到癌症重新激活靶向途径,因此复发率较高。而癌症免疫疗法的复发率较低,博具优势。基于免疫疗法中,T细胞既具有记忆能力,又具有癌细胞难以逃避的多克应,科研人员希望免疫疗法可以诱导长期反应。然而,初始耐药性和治疗一段时间后,其获得性耐药毅然是限制检查点阻滞疗效的主要因素。表现在单用PD-1通路阻断剂的毒性发生率为10-15%;这需要3-4级的医学干预。大多数单用抗PD-1抗体或抗PD-L1的抗体治疗的患者,其毒性预期并没有高于安慰剂组。治疗中的死亡案例非常罕见。极少数(约5%)因毒性而停止治疗。治疗中最常见的不良事件是,有15-20%的患者出现疲劳、腹泻、皮疹和瘙痒,部分患者出现内分泌失调,如10-15%甲状腺疾病、1-3%垂体炎、肾上腺疾病和1% I型糖尿病。其中,免疫细胞浸润产生激素的腺体,导致永久性功能障碍,患者终身需要接受替代性激素治疗。也有约1%患者,毒性严重到影响任何器官,危及生命。
2.1 免疫检查点CTLA-4与相关临床试验
有研究发现,细胞毒性T淋巴细胞相关蛋白4(CTLA-4),在调节T细胞反应中具有强大的抑制作用,这一发现具有里程碑式的意义。虽然在静息T细胞中,CTLA-4是胞内蛋白,但是当T细胞受体(TCR)和CD28发出共刺激信号后,CTLA-4就会转移至细胞表面,随后竞争性地与CD28和关键共刺激分子(CD80、CD86 )结合,并介导抑制信号进入T 细胞,从而抑制T细胞的增值和活化。
这一作用,在CTLA-4缺陷型小鼠模型实验中进一步证实,动物的死因绝大部分涉及器官的爆发性淋巴细胞浸润,但是使用皮质类固醇或其他免疫抑制剂,能够控制这些副作用。随之,Bluestone继续采取同一策略控制自身免疫性疾病。Allison认为,如果这种分子“刹车”能够被抗体短暂阻滞,就可能会使T细胞增殖,并被过度激活。初期临床前原理验证研究表明,使用抗体阻断CTL1-4能够导致小鼠肿瘤持续性消退。自此,开始了对该策略进行临床评估。
2000年,两种人CTLA-4阻断抗体ipilimumab和tremelimumab被用于晚期癌症患者的临床试验,发现使用CTLA-4阻断抗体出现持久性肿瘤消退现象,尽管罕见,并伴有一系列与组织特异性炎症相关的毒性,包括小肠结肠炎、炎性肝炎和皮炎性。然而,也有罕见的副作用,包括甲状腺、垂体和肾上腺炎症,这部分患者需要终身接受激素治疗。CTLA-4阻断剂的临床活性在晚期转移性黑色素瘤患者中最为明显,15%的患者,肿瘤大小,血液指标等都产生了变化。ipilimumab 治疗后的放射成像显示,ipilimumab的作用与那些直接作用于T细胞增殖途径的药物不同,部分使用ipilimumab治疗的患者会在治疗初期,偶有响应延缓的状况,或产生新的肿瘤,然而,待极限肿瘤尺寸缩小后,新的肿瘤也逐渐消退。但是不能通过监管部门审核评估的指标,即客观反映率和无进展生存,导致CTLA-4疗法难以通过监管。相反,ipilimumab 的疗效评估则需要以总生存期为指标,它是一个长期过程,是登记实验的最终结果。最终,两项大型3期 实验显示,与肽疫苗或达卡巴嗪化疗(标准)相比,ipilimumab 是位于第一,能显著延长转移性黑色素瘤存活率。2011年,ipilimumab 获得了FDA的批准,而Tremelimumab仍在临床试验观察,其它CTLA-4 阻断抗体,近期已进入临床试验阶段(NCT02694822)。
鉴于相对较低反应率和CTL-4阻断相关毒性的高发性,鉴定能够预测患者是否对CTL-4阻断剂有反应的生物标志物非常重要。有研究观察患者是否有反应,具有较高的肿瘤突变负荷与较高的反应可能性相关。治疗后外周血的淋巴细胞数量的增加,以及诱导型共刺激分子ICOS的临床前小鼠研究表明,具有FC结构域的CTL-4阻断抗体可以在退化的肿瘤中消耗调节性T细胞(RegulaTory T cell,Tregs),但是临床实验证据仍然很少。最近启动的临床试验(NCT03110307),采用了具有非岩藻糖基化的FC结构、能够消耗Tregs的ipilimumab来验证该假设。
3. CTLA-4和PD-1-PD-L1的联合阻滞治疗
2009年12月,研究人员首次给一名患者采用两种检查点阻滞剂的联合治疗,分别是阻断CTLA-4的ipilimumab和阻断PD-1的nivoLumab。原理是依据两种途径的非冗余共抑制作用而设计,临床前研究也显示了这两种途径可协同作用。此外,由于CTLA-4和PD-1通路的阻断功能可作用于不同的免疫环境,以获取新的作用机制。CTLA-4也可能影响淋巴结引流的抑制信号。尽管PD-1阻断可能具有同一活性,但是存在于肿瘤中的PD-1和肿瘤微环境中的免疫细胞可能在杀伤肿瘤上更具优势。近期,使用细胞计数(或CYTOF),Allison实验室证实CTAL-4和PD-1阻断可导致T细胞亚群中出现不同的表型特征 。针对转移性黑色素瘤患者的ipilimumab与nivoLumab联合应用的初始1期计量试验,选定其中反应率超过50%的患者,进入2期和3期试验。结果显示,比单一用药反应率更强,高达60%。ipilimumab与nivoLumab联合治疗的2期和3期研究确证,有约60%的反应率,分析显示,初期随机分组的患者3年生存率为58%与52%,略高于初期接受nivoLumab治疗的患者,但毒副作用率较高。初期试验初步确定了需要联合治疗的患者,重点是PD-L1在肿瘤中的表达,治疗中发现,使用PD-L1后,显示低表达或零表达(肿瘤细胞表面染色阳性率∠1%)的患者联合用药,比单独用nivoLumab,提高了生存率。目前正在寻究一种适应性的给药方案,以评估早期反应,试图使用最小的组合剂量,降低毒性(NCT03122522)。图1为作用原理示意。
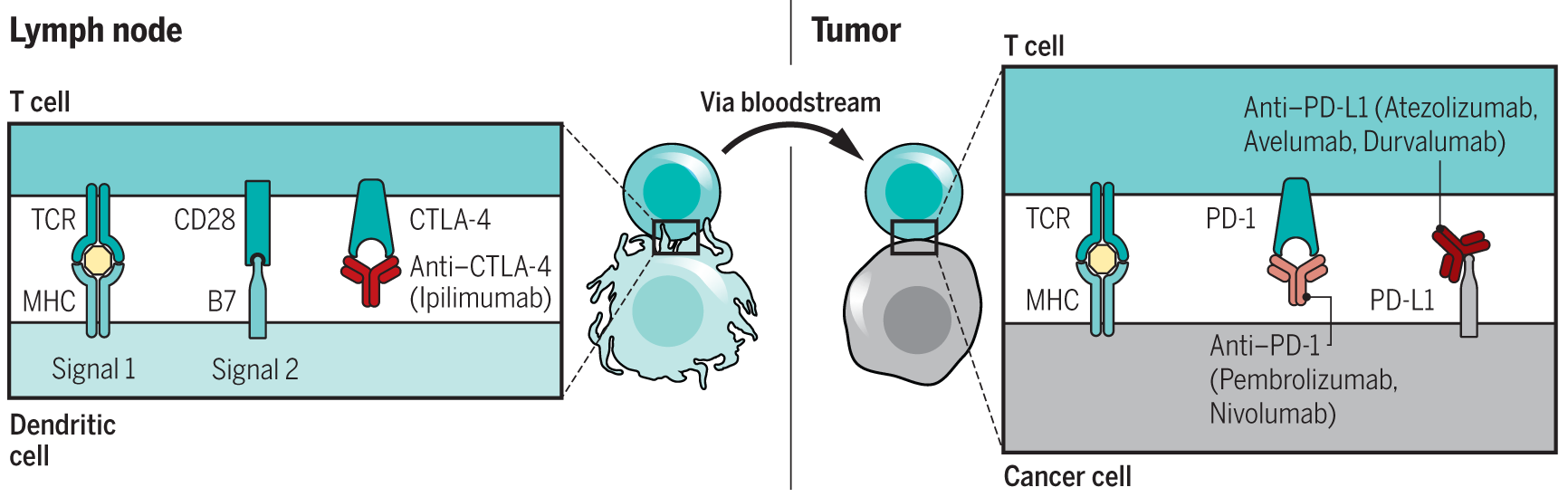
图1. 阻断CTLA-4和PD-1和PD-L1以诱导抗肿瘤反应。( 图来源:Cancer immunotherapy Using checkpoint blockade. Corrected 26 March 2018. See full text. )(左)CTLA-4是一种负调节因子在识别淋巴结中抗肿瘤T细胞的特异性后,它初始激活所需的共刺激由抗原呈递细胞呈递的肿瘤抗原。CTLA-4的激活可以用抗CTLA-4阻断抗体。(右)一旦T细胞被激活,它们就会在全身循环,找到呈递的同源抗原癌症细胞。在识别后,TCR的触发导致负调控受体的表达PD-1和IFN-g的产生导致PD-L1的反应性表达,从而关闭抗肿瘤T细胞反应。这种负性相互作用可以被抗PD-1或抗PD-L1抗体阻断。
4. 免疫检查点的其它组合与潜在性
目前,大量研究集中在免疫检查点阻断剂和其他化疗药物的联用效果,其效果评价是以增加检查点阻断剂受益的患者数量为评价标准,治疗效果值得关注。但是存在受试者多与实验基数太多的问题,导致预期实验难以得到可靠的验证。
在免疫检查点阻断剂研究基础上,一些基于药物机制组合的新思路正在陆续成为后续的研发目标。即, 对免疫检查点阻断治疗的原发性和获得性抗性的细胞和分子机制的理解,促进组合免疫疗法的研发。当肿瘤中T细胞处于低水平时,除了抗CTLA-4和抗PD-1疗法的组合外,其它方法,包括直接注射干扰素诱导分子,如Toll受体激动剂、溶瘤病毒、阻断吲哚胺2、3-双加氧酶或精氨酸酶等T细胞排除蛋白,以及抑制Tregs或巨噬细胞等免疫抑制细胞来改变肿瘤微环境。
有研究显示,放射疗法、化疗法和癌基因靶向治疗法,可改变免疫抑制性肿瘤微环境,而且可能与免疫检查点阻断剂联合,产生协同作用。虽然在已有成功经验上继续推进临床试验非常重要,但是从基础研究获得理论依据,对后续研发思路同样十分重要。
表1.抗PD-1和抗PD-L1 疗法的主要适应症与引发抗肿瘤应答的可能机制
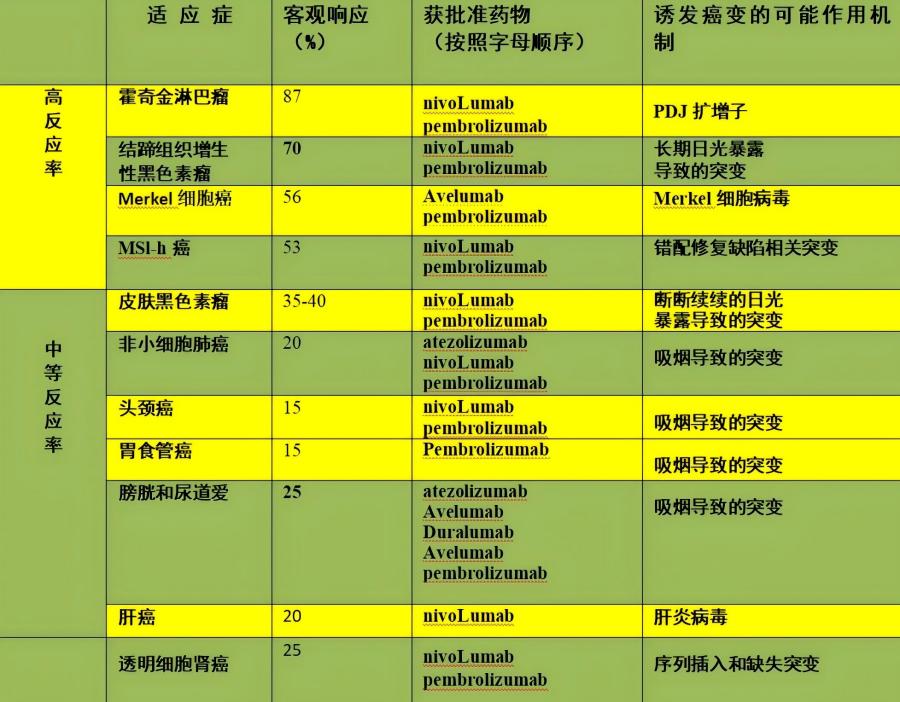
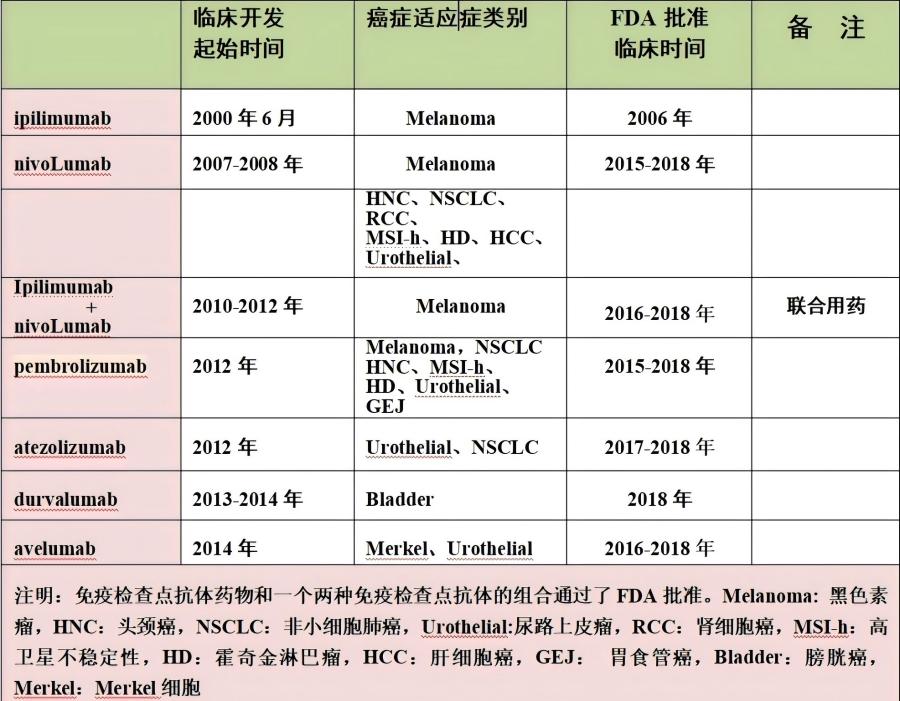
表2. 抗体CTLA-4、抗PD-1和抗PD-L1抗体首个人体FDA批准到临床开发时间表
结 语
免疫检查点抑制剂(Immune checkpiont inhibitors, ICI),广泛用于癌症临床治疗策略,其优势体现在其可抑制免疫检查点导致的耐药性问题。分析科学文献中的相关的实验证据,Gascon等试图证明循环和肺癌浸润淋巴细胞是否可以作为肺癌患者的可靠预测生物标志物?即利用ICI治疗非小细胞肺癌(NSCLC),它是具抗药性的侵袭性肺肿瘤,尽管循环细胞已被广泛用作ICI反应性的细胞生物标志物,但仍需做大量的实验验证,以便更准确的定义生物标志物,更经济的预测NSCLC应答者/无应答者。将浸润肺肿瘤微环境的免疫细胞与血液中循环的免疫细胞进行比较,可以形成更好的方式来预测NSCLC患者中的ICI反应者和非反应着。
在某些情况下,ICI的表达会在患者中引起严重的副作用。用nivoLumab和pembrolizumab单抗阻滞PD1,用atezolizumab、avelumab和durvalumab联合阻滞PD-L1,并与放化疗联合应用,对各种侵袭性肿瘤都显示出明显的效果。Correale等在对NSCLC、黑色素瘤、头颈癌和肾癌的试验表明,抑癌效果显著。但是在治疗过程中经常发生严重的副作用,影响了癌症患者的临床随访。进而影响基于ICI的放化疗的成功。这些免疫介导的不良反应被归类于免疫介导的不良事件,是由免疫系统的不可预测的功能障碍直接或间接引发的。因此,寻究不良事件的标志物是当前迫切需要的研究目标或任务。Correale等人观察到,ICI相关性肺炎(ICI-related Pneumonitis,IRP)是最常见的免疫介导的不良事件之一,常发生在接受抗CTLA-4和PD-1/PD-L1的NSCLC患者中。ICI治疗黑色素瘤患者也可能发生IRP,但较NSCLC患者严重程度低。
预测NSCLC患者是否会发生IRP非常重要,主要因为IRP症状会演变为缺氧和紫绀等不可逆的损害,甚至引发呼吸衰竭。通过对256名接受PD-1/PD-L1阻断的癌症患者进行多重点的分析证实,发生IRP的风险与I类和II类人类白细胞抗原(human leukocyte antigen, HLA)的表达水平相关。
参考文献:
1 .Fabr izio Mattei. Carlos Alfaro and keisari. Cancer Immunology; From Molecuar mechanisms to therapeutic Opportunities. Cells, 2022 , 11(3): 459
2 .Peter J. Stambrook, John Maher and Farzin Farzaneh, Cancer Immunotherapy: Whence and Whither . Mol Cancer Res; 2017; 15(6); 635–650. Published Online First March 29, 2017.
3 .Antoni Ribas & Jedd D. Wolchok, Cancer immunotherapy using checkpoint blockade. Science, 2018 , 359: 1350-1355
4 .June et el. CAR T cell immunotherapy for human cancer. Science, 2018, 359: 1361-1365.
5 . Ott PA, Hodi FS, Robert C. CTLA-4 and PD-1/PD-L1 blockade:
new immunotherapeutic modalities with durable clinical benefit in melanoma patients. Clin Cancer Res , 2013; 19:5300-5309
6 .J. D. Wolchok et al., A methodological framewook to enchance the clinical success of cancer immunotherapy . Clin. Cancer Res. 15,2009,15:7412–7420
7. Madore J, Vilain RE, Menzies AM, KakavandH, Wilmott JS,HymanJ. PD-L1 expression in melanoma shows marked heterogeneity within and between patients: Implications for anti-PD-1/PD-L1 clinical trials. Pigment Cell and Melanoma Res .2015; 28:245–253.
8 . Gascon, M.; lsla, D.; Cruellas, M.; Galvez, E.M.; Lastra, R.; Ocariz, M.; Pano,J.R.;
Ramirez,A.; et al. Intratumoral Versus circulaiting Lymphoid Cells as Predictive Biomarkers in Lung Cancer Patients Treated with Immunecheckpoint Inhibitors: Is the Easiest Path the Best One? Cells 2020, 9, 1525. [CrossRef] [PubMed]
9 .Crreale, P.; Saladino, R.E.; Giannarelli, D.; Sergi, A.; Mazzei,M.A.; et al HLA Expression Correlates to the Risk of Immune-Checkiont Inhibitor-Induced Pneumonitis.
Cells 2020, 9, 1964. [CrossRef] [PubMed]
10 .Pierpaolo Correale, Rita Emilena Saladino Diana Giannarelli,Andrea Sergi , Maria Antonietta Mazze . et al Expression Correlates to the Risk of Immune Checkpoint Inhibitor-Induced Pneumonitis . Cells 2020, 9, 1964; doi:10.3390/cells 9091964